Глава IV.11.
Обмен углеводов
Функции углеводов
1.
Энергетическая
(глюкоза, гликоген).
2.
Структурная
(гиалуроновая кислота).
3.
Антикоагулирующая
(гепарин).
4.
Гомеостатическая
(поддерживает, в частности, водно-электролитный баланс и осмотическое давление
крови).
5.
Механическая
(входят в состав соединительной ткани).
Классификация углеводов
Моносахариды, которые не могут быть гидролизованы на
более простые сахара. В зависимости от числа атомов углерода их подразделяют на
триозы, тетрозы, пентозы, гексозы. В зависимости от присутствия альдегидной или
кетоновой группы на альдозы и кетозы.
Дисахариды состоят из двух остатков моносахаридов:
1)
сахароза
состоит из остатков глюкозы и фруктозы, соединенных a-1,4-гликозидной связью;
2)
лактоза
состоит из остатков глюкозы и галактозы, соединенных b-1,4-гликозидной связью;
3)
мальтоза
состоит из двух остатков глюкозы, соединенных
a-1,4-гликозидной связью;
4)
целлобиоза
состоит из двух остатков глюкозы, соединенных b-1,4-гликозидной связью.
Гомополисахариды - длинные разветвленные
цепи, состоящие из одних и тех же моносахаридов:
1)
крахмал
- полимер глюкозы, соединенной a-1,4 и a-1,6-гликозидными связями. При этом неразветвленные
цепи образуют амилозу (20%), а разветвленные амилопектин (80%);
2)
гликоген
- животный крахмал, состоящий из остатков глюкозы. Это более разветвленный
полимер, чем крахмал. При частичном гидролизе крахмала или гликогена образуются
декстрины (более короткие разветвленные цепи);
3)
целлюлоза
- главный компонент структурной основы растительных клеток. Это линейный
полимер глюкозы, соединенной b-1,4-гликозидными связями.
Гетерополисахариды состоят из разных
мономеров:
1)
гепарин
содержит остатки D-глюконат-2-сульфита и N-ацетилглюкозамин-6-сульфата;
2)
гиалуроновая
кислота состоит из остатков D-глюкуроновой кислоты и
остатков N-ацетилглюкозамина. Входит в состав соединительной
ткани и участвует в регуляции проницаемости кканей.
Переваривание и всасывание углеводов
У
моногастричных животных в ротовой полости
под действием амилазы (a,
b)
слюны происходит частичный гидролиз гликозидных связей полисахаридов
(крахмала). Но активность этого фермента низкая, особенно у плотояндых.
В желудке специфических ферментов нет,
а амилаза при низкой рН быстро инактивируется.
В тонком
отделе кишечника происходит основной гидролиз сахаров. Крахмал под действием амилазы
поджелудочной железы, протоки которой открываются в 12-перстную кишку
расщепляется до мальтозы и изомальтозы. Этот дисахарид, а также сахароза и
лактоза расщепляются специфическими гликозидазами - мальтазой, изомальтазой, сахаразой и лактазой. Эти
ферменты продуцируются клетками слизистой и не поступают в просвет, а действуют
на поверхности оболочки кишечника. Это т.н. пристеночное пищеварение.
Дисахариды расщепляются до моносахаридов: глюкозы, фруктозы и галактозы,
которые всасываются в стенки кишечника и поступают в кровь. Проникновение
моносахаридов через клеточные мембраны происходит путем облегченной диффузии
при участии специальных ферментов транслоказ. Глюкоза и галактоза еще проникают
и путем активного транспорта за счет градиента концентраций ионов Na+, который создается Na+-К+-АТФ-азой
(насос).
У
полигастричных животных в ротовой полости переваривание сахаров не происходит из-за
отсутствия ферментов.
В рубце (первом из преджелудков)
происходит 50% переваривания сахаров. Ферменты вырабатываются микрофлорой рубца
(мальтаза,
сахараза, целлюлаза).
Образовавшиеся в результате ферментативного гидролиза поли- и дисахаридов
моносахара под действием бактерий рубца
подвергаются процессам брожения, среди которых выделяют следующие виды:
1)
уксуснокислое
(Глю = уксусная кислота
+ СО2);
2)
пропионовокислое
(Глю = пропионовая
кислота + СО2);
3)
маслянокислое
(Глю = масляная кислота
+ СО2);
4)
молочнокислое
(Глю = молочная
кислота + СО2).
Все эти кислоты называются летучими жирными
кислотами (ЛЖК). Наилучший вариант, когда уксуснокислое брожение составляет 70%
и хуже когда преобладает маслянокислое. ЛЖК всасываются в стенки сетки и книжки
и идут на энергетические нужды организма.
В сычуге (истинный желудок, имеет
строение как и у моногастричных) переваривания углеводов не происходит из-за
отсутствия ферментов.
В тонком
отделе кишечника идет переваривание остатков сахаров как и у моногастричных животных.
Гликолиз
Последовательные реакции гликолиза катализируются
группой из 11 ферментов. Процесс представляет собой две стадии (рис.4.11.1.).
На первой из них глюкоза (Г) фосфорилируется
и затем расщепляется с
образованием двух молекул трехуглеродного соединения - глицеральдегид-3-фосфата. Эту стадию рассматривают как
подготовительную. Именно на ней различные гексозы вовлекаются в гликолиз,
фосфорилируются за счет АТФ и в итоге образуют общий продукт (Г-3-Ф). Вторая
стадия представляет процесс общий для всех сахаров. Он включает и
окислительно-восстановительные реакции и этапы образования АТФ (т.е. накопления
энергии).

Первая
стадия
1)
Фосфорилирование
Г за счет АТФ до образования глюкозо-6-фосфата
(Г-6-Ф).
Эта реакция является пусковой для всего процесса и
идет в одном направлении.
Е: гексокиназа и глюкокиназа.
Гексокиназа более важный фермент, он используется в большинстве клеток. Он
фосфорилирует еще фруктозу, маннозу. Глюкокиназа содержится только в
гепатоцитах и обладает сродством только к глюкозе.
Кофакторами этой реакции являются ионы
магния и марганца.
2)
Превращение
Г-6-Ф во фруктозо-6-фосфат
(Ф-6-Ф). Эта реакция изомеризации.
Е: фосфоглюкоизомераза.
Реакция обратимая.
Кофакторы: иона магния и марганца.
3)
Фосфорилирование
Ф-6-Ф до фруктозо-1,6-дифосфата
(Ф-1,6-ДФ).
Эта вторая пусковая реакция гликолиза требует
затраты еще одной молекулы АТФ. Реакция необратима.
Кофактор: ионы магния. Донорами фосфата могут быть помимо АТФ УТФ.
Активность этого фермента активируется АДФ и АМФ и
ингибируется АТФ.
4)
Расщепления
Ф-1,6-ДФ на две молекулы глицеральдегид-3-фосфат
(ГА-3-Ф).
Е: альдолаза.
Содержит свободные SH-группы. Реакция обратимая и идет в две стадии.
Вначале образуется одна молекула ГА-3-Ф и диоксиацетонфосфат, а затем последний
превращается в еще одну молекулу ГА-3-Ф.
Данная реакция завершает подготовительную стадию, на
которой было истрачено 2 молекулы АТФ и образовалось 2 молекулы ГА-3-Ф.
Вторая
стадия
Здесь все реакции идут двумя параллельными путями.
5)
Окисление
ГА-3-Ф до 1,3-дифосфоглицерата
(1,3-ДФГ).
Энергия, освобождающаяся при окислении альдегидной
группы ГА-3-Ф, сохраняется в форме высокоэргического продукта 1,3 - ДФГ.
Е: глицеральдегид-3-фосфатдегидрогеназа
(ГА-3-Ф-ДГ).
Кофермент: НАД, который в ходе
реакции восстанавливается.
6)
Превращение
1,3-ДФГ в 3-фосфоглицерат
(3-ФГ).
Е: фосфоглицераткиназа.
Образуется одна молекула АТФ.
7)
Превращение
3-ФГ в 2-фосфоглицерат
(2-ФГ). Это реакция изомеризации.
Кофактор: ионы магния.
8)
Превращение
2-ФГ в фосфоенолпируват.
Е: енолаза.
Кофакторы: ионы магния и марганца.
Ингибитор: фторид.
9)
Превращение
фосфоенолпирувата в пируват.
Образуется одна молекула АТФ.
Е: пируваткиназа.
Кофакторы: ионы магния, марганца,
калия.
Ингибирор: ионы кальция (конкурируют с
марганцем).
10)
Восстановление
пирувата до лактата.
Источником электронов служит ГА-3-Ф, а их переносчиком является НАДН.
Лактат (молочная кислота) - конечный продукт
анаэробного гликолиза. Выделяется через плазматическую мембрану как конечный
метаболит. При усиленной работе мышц возникает дефицит кислорода и окисление
глюкозы идет до лактата, при этом в мышечной ткани из-за накопления кислоты
возникает ацидоз.
Пентозофосфатный
путь (ПФП)
Наряду с гликолитическим путем распада глюкозы во
многих клетках работает пентозофосфатный путь (гексамонофосфатный шунт). Он не
является основным для метаболизма глюкозы и служит для генерации в цитоплазме
клетки восстановленных форм НАДФ.
Данный кофермент необходим для реакций восстановительного синтеза жирных кислот
и стероидов, а также используется как донор водорода в реакциях
гидроксилирования с участием
цитохром-Р450-зависимой системы. Все эти процессы протекают преимущественно в
клетках печени, молочной железы, коры надпочечников и жировой ткани. Скелетные
мышцы, где синтез жирных кислот протекает вяло, практически лишены
пентозофосфатного пути метаболизма глюкозы.
Реакции
представлены окислительной и неокислительной ветвями.
Окислительная ветвь:
1.
Дегидрирование
1-го углеродного атома глюкозо-6-фосфата.
Е: глюкозо-6-фосфатдегидрогеназа. В качестве акцептора
электронов выступает НАДФ+. Образуется 6-фосфоглюколактон
- внутренний эфир.
2.
6-фосфоглюколактон
очень нестабильное соединение, легко
гидролизуется до свободной кислоты с образованием 6-фосфоглюконата.
Е: фосфоглюколактоназа.
3.
Окислительное
декарбоксилирование 6-фосфоглюконата с образованием рибулозо-5-фосфата.
Е: 6-фосфоглюконатдекарбоксилазы
и 6-фосфоглюконатдегидрогеназы (акцептор - НАДФ + ).
Т.о. окислительная ветвь завершается восстановлением
двух молекул НАДФ+
Неокислительная ветвь это
реакции изомеризации:
1.
Рибулозо-5-фосфат
превращается в рибозо-5-фосфат.
Е: фосфопентозоизомераза.
2.
Рибозо-5-фосфатпревращается
в ксилулозо-5-фосфат.
3.
Ксилулозо-5-фосфат
взаимодействует с рибозо-5-фосфатом
превращается в седогептулозо-7-фосфат
и глицеральдегид-3-фосфат.
Последнее вещество является также продуктом гликолиза.
Е: транскетолаза (простетическая група ТДФ).
4.
Седогептулозо-7-фосфат
и глицеральдегид-3-фосфат взаимодействуют между собой и превращаются в фруктозо-6-фосфат
(также продукт гликолиза) и эритрозо-4-фосфат.
Е: трансальдолаза.
5.
Эритрозо-4-фосфат
и ксилулозо-5-фосфат взаимодействуют между собой и певращаются в два продукта
гликолиза фруктозо-6-фосфат и глицеральдегид-3-фосфат.
Е: транскетолаза.
Часть
метаболитов реакций неокислительного этапа ПФП является одновременно и
метаболитами гликолиза, а это означает, что между двумя метаболическими путями
глюкозы существует тесная связь и в
зависимости от условий, возникающих в клетке, возможно "переключение"
с одного пути на другой.
При
сбалансированной потребности клетки в НАДФН и рибозо-5-фосфате, ПФП
заканчивается на окислительной этапе.
Если
потребность в рибозо-5-фосфате превышает потребность в НАДФН, то окислительный
этап ПФП "обходится" за счет гликолиза. Метаболиты гликолиза:
фруктозо-6-фосфат и глицеральдегид-3-фосфат превращаются в рибозо-5-фосфат.
Если
больший дефицит в НАДФН, чем в рибозо-5-фосфате, то
1.
при
высоком энергетическом статусе клетки рибозо-5-фосфат превращается в глицеральдегид-3-фосфат
и фруктозо-6-фосфат, а последние идут не на путь гликолиза, а на глюконеогенез,
т.к. нет потребности в генерации АТФ;
2.
при
низком энергетическом статусе клетки фруктозо-6-фосфат и
глицеральдегид-3-фосфат образовавшиеся из рибозо-5-фосфат, включаются в
гликолиз и превращаются в пируват. В этом случае синтезируется АТФ.
Биологический
смысл ПФП:
- в
результате реакций окислительной ветви образуются две молекулы НАДФН, которые
не окисляются в дыхательной цепи (как НАДН), а служат донорами водорода
в ряде восстановительных реакций;
- в
неокислительной ветви генерируется рибозо-5-фосфат, необходимый для
синтеза РНК, ДНК, НАД, ФАД;
-
ПФП называют еще и пентозофосфатным шунтом т.к. это процесс паралельный
основному пути окисления глюкозы - гликолизу и при определенных условиях
(см. выше) происходит переключение с
дополнительного ПФП на основной гликолиз и наоборот.
Цикл
трикарбоновых кислот (ЦТК, цикл лимонной кислоты, цикл Кребса)
Аэробный путь окисления глюкозы начинается с того, что пировиноградная кислота (ПВК, пируват) не превращается в лактат, а поступает в ЦТК.
ЦТК представляет собой серию реакций, протекающих в
матриксе митохондрий, в ходе которых осуществляется катаболизм ацетильных групп
(до СО2) и образование НАДН2 и ФАДН2.
Восстановленные коферменты переносят водород на дыхательную цепь, где
осуществляется окислительное фосфорилирование (см. главу "Обмен веществ и
энергии").
Суммарное
уравнение аэробного окисления одной молекулы глюкозы:
1-Глюк + 6 О2 = 6
СО2 + 6 Н2О + 38 АТФ
Прежде чем ПВК вступит на путь ЦТК она подвергается
окислительному декарбоксилированию при участии комплекса ферментов. Результатом
такого взаимодействия является образование ацетил-КоА. В
таком виде это соединение поступает на путь ЦТК
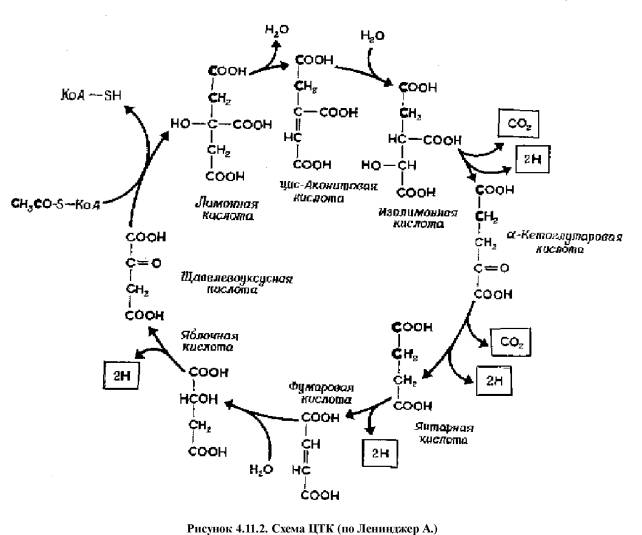
1.
ацетил-КоА + оксалоацетат
(щавелевокуксусная кислота) ® цитрат (лимонная
кислота) + КоА
Е: цитратсинтетаза;
2.
цитрат ® цис-аконитат
+ Н2О
Е: аконитаза;
3.
цис-аконитат + Н2О ® изоцитрат
4.
изоцитрат + НАД+ ® альфа-кетоглутарат
+ СО2 + НАДН2
Е: изоцитратдегидрогеназа
/ декарбоксилаза;
5.
альфа-кетоглутарат + НАД+ ® сукцинат
(янтарная кислота) + СО2 + НАДН2
Е: альфа-кетоглутаратдегидрогеназа / декарбоксилаза;
6.
сукцинат + ФАД+ ® фумарат + ФАДН2
7.
фумарат + Н2О ® малат (яблочная
кислота)
Е: фумараза;
8.
малат + НАД+ ® оксалоацетат
+ НАДН2
Регуляторные ферменты:
1)
пируватдегидрогеназа
(Ингибиторы: АТФ, НАДН, цитрат, Ац-КоА);
2)
цтратсинтаза
(Ингибиторы: АТФ, НАДН, ВЖК);
3)
Изоцитратдегидрогеназа
(Ингибиторы: АТФ, НА;ДН);
4)
Кетоглутаратдегидрогеназа
(Ингибиторы: АТФ, НАДН).
ЛИТЕРАТУРА К ГЛАВЕ IV.11.
1. Бышевский А. Ш., Терсенов
О. А. Биохимия для врача // Екатеринбург: Уральский рабочий, 1994, 384 с.;
2. Кнорре Д. Г., Мызина С.
Д. Биологическая химия. – М.: Высш. шк. 1998, 479 с.;
3. Ленинджер А. Биохимия. Молекулярные основы
структуры и функций клетки // М.: Мир, 1974, 956 с.;
4. Пустовалова Л.М. Практикум по биохимии //
Ростов-на Дону: Феникс, 1999, 540 с.
5. Методы биохимических
исследований (липидный и энергетический обмен). Под ред. М.И.Прохоровой // Л.:
Изд-во Ленинградского университета, 1982. - 327 с.;
6. Ньюсхолм Э., Старт К.
Регуляция метаболизма. Под ред. Э.Г.Ларского. - М.: Мир, 1977. - 407 с.