Глава IV.9.
Обмен белков
Важный
критерий пищевой ценности белков – доступность аминокислот. Аминокислоты большинства
животных белков полностью высвобождаются в процессе пищеварения. Исключение
составляют белки опорных тканей (коллаген и эластин). Белки растительного
происхождения перевариваются в организме плотоядных плохо, т.к. содержат много
волокон и иногда ингибиторы протеаз (соя, горох). У жвачных растительные белки
перевариваются под действием ферментов микрофлоры рубца. Существенный критерий
ценности пищевого белка – аминокислотный состав. Чем больше содержится
незаменимых аминокислот, тем полезнее данный белок для организма.
Переваривание и всасывание белков
В ротовой полости не происходит.
В желудке главные клетки слизистой
оболочки секретируют пепсиноген – предшественник протеолитического фермента пепсина.
В результате аутокатализа в кислой среде желудочного сока фермент активируется.
Соляная кислота поддерживает рН в пределах 1,5-2,0. Это оптимальные условия для
активной работы фермента. В кислой среде белки корма подвергаются денатурации,
что делает их более доступными ферментативному протеолизу. Пепсин быстро
гидролизует в белках пептидные связи, образованые ароматическими аминокислотами
и медленно связи между лейцином и дикарбоновыми аминокислотами.
В тонком
отделе кишечника происходит дальнейший гидролиз пептидов до аминокислот. Туда поступает
панкреатический сок с рН 7,8-8,2. Он содержит неактивные предшественники
протеаз: трипсиноген, химотрипсиноген,
прокарбоксипептидазу,
проэластазу. Слизистой кишечника вырабатывается фермент энтеропептидаза,
который активирует трипсиноген до трипсина, а последний уже все остальные
ферменты. Протеолитические ферменты содержатся также в клетках слизистой
кишечника, поэтому гидролиз небольших пептидов происходит после их всасывания.
Конечный результат действия ферментов желудка и кишечника – расщепление почти всей
массы пищевых белков до свободных аминокислот.
Всасывание аминокислот происходит в тонком отделе
кишечника. Это активный процесс и требует затраты энергии. Основной механизм
транспорта – гамма-глутамильный цикл. В нем участвует 6 ферментов и трипептид глутатион
(глутамилцистеинилглицин). Ключевой фермент – гамма-глутамилтрансфераза.
Кроме того, процесс всасывания АК требует присутствия ионов Na+. Аминокислоты попадают в
портальный кровоток – в печень и в общий кровоток. Печень и почки поглощают
аминокислоты интенсивно, мозг избирательно поглощает метионин, гистидин,
глицин, аргинин, глутамин, тирозин.
В толстом
отделе кишечника не всосавшиеся по каким-либо причинам (недостаток или низкая
активность протеолитических фрементов, нарушение процессов транспорта АК)
пептиды и АК подвергаются процессам гниения. При этом образуются такие продукты
как: фенол,
крезол,
сероводород,
метилмеркаптан,
индол,
скатол,
а также группа соединений под общим названием «трупные яды» - кадаверин,
путресцин.
Эти вещества всасываются в кровь и поступают в печень, где подвергаются
конъюгации с глюкуроновой
кислотой и другим процессам обезвреживания (см. подробнее главу
"Биохимия печени"). Затем они выводятся из организма с мочой.
Переваривание белков у жвачных
Под действием ферментов микрофлоры рубца белки гидролизуются до АК, которые могут использоваться двумя путями:
1) идти на синтез белков
микрофлоры рубца;
2) подвергаться процессу
брожения;
Вновь образовавшаяся микрофлора поступает в сычуг и далее подвергается действию ферментов как и у моногастричных животных. Сбраживание АК завершается образованием летучих жирных кислот (ЛЖК: молочной, масляной, уксусной, пропионовой) и аммиака. Данные продукты в свою очередь идут:
1) на
синтез белков микрофлоры рубца;
2) поступают
в кровь и идут на энергетические нужды.
Пути использования АК в организме
1)
синтез
собственных белков организма (см. главу "Матричный биосинтез);
2)
при
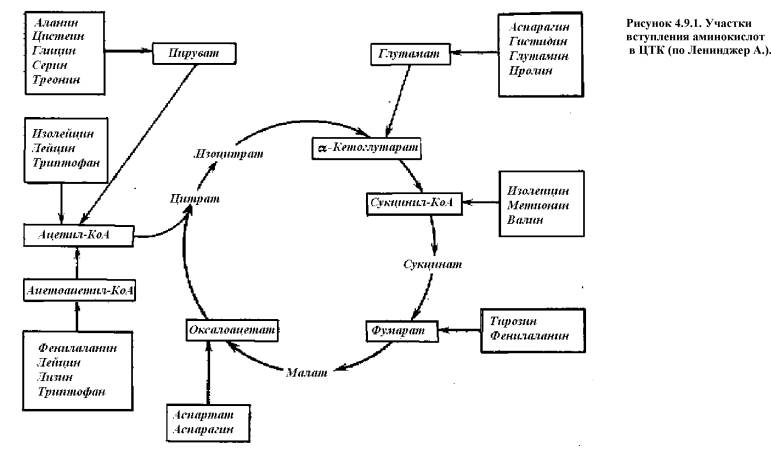
дефиците энергии участие в ЦТК (рис. 4.9.1.);
3)
участие
в образовании биологически активных веществ (БАВ).
Ряд аминокислот в клетках подвергается химической
модификации:
1)
окислительное дезаминировние или отщепление аминогруппы катализируется
ферментами класса аминооксидаз. Они очень специфичны и малоактивны. Единственный
высокоактивный фермент работает в печени и мозге – это глутаматдегидрогеназа
(ГДГ). Он катализирует превращение глутаминовой
кислоты в альфа-кетоглутаровую;
2)
переаминироване. Происходит обмен аминогруппы на кетогруппу между амино- и кетокислотой.
Глутаминовая кислота взаимодействует с пировиноградной,
при этом образуется альфа-кетоглутаровая кислота и аланин;
3) декарбоксилирование или отщепление
карбоксильной группы с образованием СО2 и амина. Катализируют
реакцию декарбоксилазы. В тканях этим процессам подвергаются в основном
гистидин, тирозин, глутаминовая кислота. Из них образуются гистамин, тирамин, гамма-аминомаслянная
кислота.
Гистамин - продукт
декарбоксилирования гистидина. Накапливается в тучных клетках. В слизистой
желудка активирует синтез пепсина и соляной кислоты. Является одним из
медиаторов воспаления.
Серотонин образуется из триптофана
преимущественно в нейронах гипоталамуса и стволе мозга. Является медиатором
этих нейронов. Разрушается под действием моноаминоксидазы обычно в печени.
Дофамин – производное тирозина. Он
является медиатором проведения нервного импульса, а также предшественником меланина,
норадреналина
и адреналина.
Процессы гниения в тонком отделе кишечника
происходят также под действием декарбоксилаз.
Биосинтез аминокислот
Если незаменимые АК должны в обязательном порядке поступать в организм с пищей, то заменимые АК могут в случае их дефицита синтезироваться одна из другой. Полностью заменимыми являются 8 аминокислот: Ала, Аск, Асп, Глк, Глн, Сер, Глн и Про. Исходными соединениями для их биосинтеза являются компоненты гликолитической цепи и ЦТК. Добавление аминогруппы чаще осуществляется при участии глутаматдегидрогеназы. Аланин из пирувата, аспарагин – из фумарата, глутамин из - альфа-кетоглутарата, из него также пролин, орнитин и аргинин, серин и глицин - из 3-фосфоглицерата. Аспартат может также образовываться из оксалоацетата с использованием в качестве донора аминогруппы от глутамата (Ф: АсАт). Аланин при участии фермента АлАт из пирувата (аминогруппа также от глутамата). Ряд других АК могут синтезироваться в организме, но по более сложным механизмам.
Биосинтез сложных белков
Пуриновые и пиримидиновые нуклеотиды. Пуриновый скелет образуется в ходе нескольких реакций из аспартата, формила, глутамина, глицина и СО2. Пиримидиновый скелет из глутамина, аспарагиновой кислоты и СО2.
Катаболизм пуриновых нуклеотидов завершается
образованием мочевой кислоты.
Катаболизм пиримидиновых нуклеотидов – аланином и аминомасляной кислотой.
Синтез
гемоглобина включает
в себя образование глобина и гема. Глобин синтезируется как и все белки.
Предшественники гема – сукцинил КоА и глицин. Из них образуется аминолевулиновая кислота (Е: аминолевулитат-синтетаза). Две молекулы аминолевулиновой кислоты конденсируются с образованием порфобилиногена (Е: порфобилиногенсинтетаза). Четыре молекулы порфобилиногена конденсируются в тетрапиррольное соединение которое модифицируется в протопорфирин. Заключительный этап – присоединение железа (Е: феррохелатаза).
Разрушение гемоглобина происходит в такой
последовательности:
1)
раскрытие
пиррольного кольца с образованием вердоглобина;
2)
удаление
железа после чего получается биливердоглобин;
3)
отщепление
глобина с образованием биливердина;
4)
восстановление
метиновой группы с получением билирубина.
Билирубин с током крови доставляется в печень, где
часть его этерифицируется при участии УТФ-глюкуронилтрансферазы.
Этерифицированный билирубин называется прямым (связанным), а
неэтерифицированный – непрямым (свободным).
Связанный билирубин выделяется с желчью в
12-перстную кишку, где после ряда превращений под действием ферментов
микрофлоры он превращается в стеркобилин и выделяется с калом или в уробилин и
выделяется с мочой. Повышение содержания билирубина в крови – билирубинемия.
Обезвреживание аммиака
Он образуется в основном при дезамировании
аминокислот.
1)
Восстановительное
аминировние происходит в малом объеме и несущественно.
2)
Образование
амидов аспарагиновой и глутаминовой кислот (аспарагина и глутамина). Этот
процесс в основном протекает в нервной ткани, где очень важно обезвреживать
аммиак.
3)
Образование
солей аммония происходит в почечной ткани (хлорид аммония удаляется с мочой).
4)
Основной
путь – синтез мочевины. Происходит в цикле мочевины или орнитиновом цикле.
У большинства наземных позвоночных аммиачный азот выводится в виде мочевины, такие организмы называются уротелическими. Костные рыбы - аммониотелические организмы, они выделяют азот непосредственно в виде аммиака. Наземные рептилии и птицы вводят азот в виде мочевой кислоты - это урикотелические организмы.
Процесс
образования мочевины протекает в печени и состоит из цикла реакций (Кребс и
Хенселяйт, 1932). Называется цикл мочевины или орнитиновый цикл.
1)
свободный
аммиак и СО2 при участии 2АТФ образует макроэргическое соединение карбамоилфосфат.
2)
Крабамоилфосфат
отдает орнитину
свою карбамильную группу, Е: орнитинтранскарбамилаза
и образуется цитрулин и Н3РО4;
3)
Цитрулин
взаимодействует с аспарагиновой кислотой с образованием аргининсукцината,
при этом АТФ переходит в АМФ. Катализирует реакцию Е: аргининсукцинатсинтаза;
4)
Аргининсукцинат
расщепляется на фумарат и аргинин
под действием Е: аргининсукцинатлиазы;
5)
Аргинин
под действием аргиназы расщепляется путем гидролиза на мочевину и орнитин.
Орнитин вновь включается в цикл. Мочевина – безвредное соединение и выводится
из организма с мочей.
ЛИТЕРАТУРА К ГЛАВЕ IV.9.
1. Бышевский А. Ш., Терсенов О. А. Биохимия для врача // Екатеринбург: Уральский рабочий, 1994, 384 с.;
2. Кнорре Д. Г., Мызина С. Д. Биологическая химия. – М.: Высш. шк. 1998, 479 с.;
3. Ленинджер А. Биохимия. Молекулярные основы
структуры и функций клетки // М.: Мир, 1974, 956 с.;
4. Пустовалова Л.М. Практикум по биохимии //
Ростов-на Дону: Феникс, 1999, 540 с.
5. Степанов В. М.
Молекулярная биология. Структура и функции белков // М.: Высшая школа, 1996,
335 с.;