КВАНТОВАЯ ХИМИЯ
Глава I.1.
Введение в курс
квантовой химии
Квантовая
химия - это наука, изучающая природу химической связи в молекулах и твердых
телах. К сожалению, в подавляющем большинстве химики в настоящее время не
осознают парадоксальность химической связи.
Прежде
всего, не ясна природа связывания, во многих случаях, о которых пойдет речь
ниже, атомов в молекулы и твердые тела, так как физика, как впрочем, и химия,
фактически не выделяет каких-либо специфических взаимодействий, ответственных
за химическую связь. Более того, если рассуждать здраво, атомы не могут
образовывать более сложные структуры вроде молекул и твердых тел!
Действительно, если молекулы и твердые тела состоят из электронов, заряженных
отрицательно, и ядер, заряженных положительно, то на первый взгляд любые
вещества (как впрочем, и существа - например, мы с вами) существовать в
принципе не могут: не смотря на то, что ядра и электроны притягиваются друг к
другу, все ядра заряжены положительно, а значит - отталкиваются друг от друга,
а значит стремятся разлетается как можно дальше друг от друга, электроны - тоже
должны вести себя аналогично.
Таким
образом, мы видим, что силе притяжения между ядрами и электронами противостоят
сразу две «черные» силы электростатического отталкивания ядер и электронов друг
от друга. Таким образом, здравый смысл отказывает в праве на существование
молекулярным телам любой сложности.
Теперь
проведем мысленный эксперимент: Представим себе, что мы гвоздями прибили к этой
доске три заряда - два положительных, на расстоянии 2а и один отрицательный - как раз посередине
между ними. Запишем теперь всем хорошо известный закон Кулона для этой системы:
![]()
![]()
Таким
образом, мы видим, что для такой простой системы, включающей два положительных
заряда и один отрицательный, силы Кулоновского притяжения между ними в восемь
раз превышают силы Кулоновского отталкивания. Вот это и есть самое грубое
представление о связывании ядер и электронов в молекулярных системах.
На
самом деле, как мы увидим дальше, природа химического связывания существенно
сложнее. Это обусловлено тем, что и ядра, и электроны являются микрочастицами,
для которых законы поведения существенно более сложны, нежели чем законы
классической механики. Прежде всего, электроны в атомах и молекулах не ведут
себя как частицы, их поведение в какой-то мере аналогично поведению заряженного
газа. Как мы видели из вышеприведенных формул, система, состоящая из трех
точечных зарядов неустойчива - она стремится слипнутся. Молекулы так себя не ведут
из-за того, что электронный газ не может весь сконцентрироваться точно
посередине между ядрами, а размыт по всему объему молекулы и, следовательно,
вся система не может слипнуться, как это должно произойти в случае точечных
зарядов. Других отличий микромира от макромира мы коснемся позднее.
В
настоящее время квантовая химия является теоретической основой всех разделов
химии - органической и неорганической, физической химии, различным видам
спектроскопии и т.д. Квантовая химия успешно решает многие научные задачи - в
стыковке со многими видами спектроскопии при помощи ее изучается строение
вещества, исследуются механизмы протекания химических реакций, в том числе - и
на поверхности, исследуются биологические и биолого-активные вещества, полезные
или летальные свойства которых часто, если не сказать - практически всегда,
связаны с их атомным и электронным строением, исследование структуры новых
высокоперспективных материалов, таких, как например, высокотемпературные
сверхпроводники, формы элементарного углерода, комплексы переходных металлов,
динамические свойства атомов и ионов в различных кристаллических и молекулярных
структурах, и многое, многое другое.
Результатом
применения методов квантовой химии является информация о плотностях электронных
состояний, распределение электронной плотности, потенциальные поверхности
реакций и барьеры перегруппировок, расчет различных спектроскопических величин,
таких как колебательные спектры, электронные и рентгеновские спектры,
оптические спектры, параметры спектров ядерного и электронного магнитных
резонансов.
В
настоящее время квантовая химия является, пожалуй, самым дешевым, доступным и
универсальным методом исследования атомной и электронной структур вещества.
Правда необходимо понимать, что человечество, тем не менее, не может совсем
отказаться от дорогостоящих экспериментальных методик исследования вещества,
так как результаты квантово-химических исследований необходимо подтверждать
ключевыми экспериментами.
Необходимо
отметить, что между экспериментальными методами и теоретическим
квантово-химическим методом, тем не менее, есть одна существенная разница: Если
методами квантовой химии и молекулярной механики можно с одинаковым успехом
исследовать как реальные, так и гипотетические структуры, то в эксперименте
можно исследовать только то, что реально существует. Так, расчет молекулы
тетраэдрана осуществим также легко, как и аналогичных расчет молекулы бутана,
тогда как тетраэдран экспериментально исследовать невозможно, так как в чистом
виде он до сих пор не получен (известно только одно его производное -
тетра-трет-бутиловое).
Тем
не менее, необходимо отметить ряд блестящих теоретических предсказаний
квантовых химиков последних лет - работа Бочвара и Гальперн, теоретически
предсказавших фуллерен и рассчитавших его электронную структуру, Корнилова -
предсказавшего нанотрубы. Эти структуры спустя двадцать лет были обнаружены
экспериментально сначала по ультрафиолетовым спектрам межзвездного газа, а
затем синтезированы в лаборатории. В 1996 году за эти работы Кречмер и Смолли
были удостоены Нобелевской премии по химии.
Впрочем,
Нобелевской премиями были также награждены и другие квантовые химики - Поллинг
- за теорию гибридизации и Хоффманн - за теорию верхних заполненных и нижних
вакантных орбиталей. Эти красивые и чрезвычайно важные для химиков воззрения мы
будем детально рассматривать позднее.
В
настоящее время теоретические модели и методы квантовой химии, по сравнению с
50 - 70 годами, когда и были сделаны вышеперечисленные работы, резко
усложнились. В настоящее время современные квантово-химические программы на
современной элементной базе позволяют рассчитывать уникальные объекты, такие
как белки, формы элементарного углерода, включающие в себя сотни и тысячи
атомов, молекулы и твердые тела, в которые входят атомы переходных элементов,
лантаноиды и актиноиды.
Тем
не менее, методы квантовой химии стремительно дешевеют. Это связано, прежде
всего, с прогрессом элементной базы вычислительной техники. Сравните - современные
синхротроны - источники электронов, протонов, рентгеновского и
ультрафиолетового синхротронного излучения стоят по несколько миллиардов
долларов за штуку, тогда как массовые компьютеры - несколько тысяч долларов,
рабочие станции - десятки тысяч и, в крайнем случае, большие суперкомпьютеры -
до миллиона долларов.
В
настоящее время, тем не менее, подавляющее большинство расчетов направлено на
получение дополнительной информации об уже известных и реально существующих
объектах. Но даже с учетом этого обстоятельства информативность теоретических
методов существенно выше! Разве можно в одном эксперименте получить равновесную
атомную структуру, дипольный момент, теплоту образования, потенциалах
ионизации, распределении зарядов, порядках связей, спиновой плотности, изучить
спектроскопические характеристики вещества? Безусловно, существует определенное
ограничение достоверности получаемых результатов, однако ограничения методов
квантовой химии известны, что позволяет во многих случаях реалистично оценивать
их точность и адекватность. В ряде же случаев надежность получаемых
квантово-химических данных даже выше, нежели чем экспериментальных. Так,
экспериментальное определение теплоты образования полициклического алкана
представляют собой длительную, дорогую, сложную и многоступенчатую процедуру,
тогда как расчет займет несколько секунд на дешевом компьютере, причем точность
будет даже выше, чем в эксперименте!
Однако
очевидно, что это редкий случай. В подавляющем большинстве случаев качество
результатов в значительной степени определяется адекватностью выбираемой
модели. Так в качестве примера можно привести исследование потенциальной кривой
образования/диссоциации молекулы водорода.
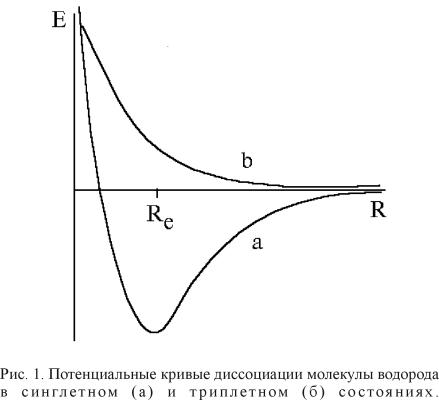
Первая
кривая получается тогда, когда в качестве волновой функции системы выбирается
синглет, т.е. когда спины электронов антипараллельны. Как видим, эта волновая
функция хорошо описывает экспериментальную кривую только в области ее минимума.
Вторая потенциальная кривая соответствует триплетной волновой функции (спины параллельны).
Как видим, она хорошо описывает только диссоциационный предел с фактически не
взаимодействующими атомами водорода. Как видим, реальную систему необходимо
исследовать с использованием волновой функции, построенной из синглета и
триплета.
С
точки зрения химика представленная реакция уникальна - рекомбинация атомарного
водорода на поверхности железа - это самая «горячая» химическая реакция, в ходе
которой можно достигнуть десяти тысяч градусов!
Как
уже упоминалось выше, квантовая химия основана на законах квантовой механики,
описывающей поведение микрочастиц. Природа микромира существенным образом
отлична от природы макромира. Человечество это начало осознавать в конце
прошлого - начале этого веков. Именно в это время стало развиваться «неклассическое»
(т.е. не древнегреческое) учение об атомизме, стала известна структура
некоторых молекул и твердых тел. Выяснилось принципиальное отличие металлов,
обладающих свободными электронами, от диэлектриков, их соответственно не
имеющих.
В
свою очередь стали известны и заряд электрона, равный -4.77*10-23СГСЕ,
его масса - 9.1066*10—28 г., масса атома водорода - 1.6734*10-24г.
и ряд других вещей.
Тогда
предполагалось, что микрообъекты можно описать классической механикой в
сочетании со статистикой. Так, например, была создана молекулярно-кинетическая
теория теплоты, которая хорошо описывала ряд наблюдаемых явлений.
В
отличие от вещества, свет представляли в виде специфической материи, непрерывно
распределенной в некоторой области пространства. Опыты по дифракции света
выявили его волновые свойства, а электромагнитная теория Максвелла вскрыла
единство природы света, радиоволн и рентгеновских лучей. В то время считалось,
что все изменения, наблюдаемые как в веществе, так и в излучении непрерывны -
энергии частиц, траектории, все характеристики меняются не скачкообразно, а
непрерывно. На принципе непрерывности была построено и классическое
представление о взаимодействии света с веществом. Поглощение света
представлялось «засасыванием» электромагнитного поля веществом, а испускание -
соответственно «истечением». Из опытов с макроскопическими телами известно, что
неравномерно движущееся заряженное тело испускает электромагнитные волны,
постепенно теряя энергию.
Однако
вскоре обнаружились ряд непонятных эффектов, которые никоим образом не могли
быть объяснены с точки зрения классической механики и электродинамики. Так
оказалось неясным поведение теплоемкости кристаллов при низких температурах, не
понятно было, почему свободные электроны не вносят вклад в теплоемкость
металлов, наконец, было установлено резкое расхождение экспериментальной и
теоретической картин спектра теплового излучения атомов («ультрафиолетовая» и
«инфракрасные» катастрофы).
Для
объяснения «ультрафиолетовой» катастрофы Планк в 1900 году предложил гипотезу о
том, что свет излучается/поглощается дискретными порциями - квантами. Энергия
кванта связана с его частотой по следующей формуле:
![]() ,
,
где
h = 1.05*10-27 эрг*сек - постоянная Планка, ![]() - циклическая частота,
равная 2pn, а линейная частота n=1/T, где T -
период колебаний. Удивительный факт - Планк до конца своих дней не мог поверить
в революционность и результативность собственной гипотезы и считал ее просто
неким курьезом.
- циклическая частота,
равная 2pn, а линейная частота n=1/T, где T -
период колебаний. Удивительный факт - Планк до конца своих дней не мог поверить
в революционность и результативность собственной гипотезы и считал ее просто
неким курьезом.
Но
дальше пошло еще хуже! Эйнштейн, опираясь на представления Планка, высказал
предположение о том, что свет не только поглощается и испускается порциями, но
и распространяется аналогично -
квантами. Квант света был назван фотоном, свойства которого были изучены
в тонких опытах Вавилова. Позднее была предложена модель волнового пакета,
качественно объясняющая особенности поведения фотонов, в частности -
фотоэффекта. Позднее был обнаружен эффект Комптона по упругому рассеянию
электронов на фотонах
Вывод
из всех этих экспериментов был на первый взгляд странный - фотон может вести
себя и как частица, и как волна.
Затем
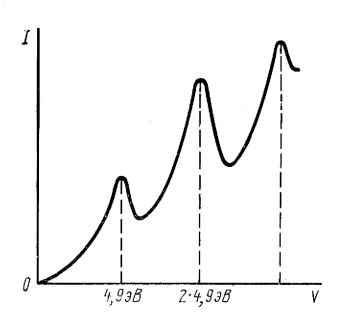
были получены аналогичные результаты и для электронов. Так, Франк и Герц,
измеряя электрический ток в парах ртути. Схема опыта была такова: Через пары
ртути пропускался поток электронов, скорость которых и, следовательно, энергия,
постепенно увеличивалась. До некоторого времени, электроны, сталкиваясь с
атомами ртути, почти не теряют своей энергии, то есть удары упругие, так что
электрический ток соответствует закону Ома, приблизительно равен приложенной
разнице потенциалов. Когда же энергия электронов становится равной 4.9 эВ, ток
резко падает. Это происходит потому, что электрон теряет энергию, сталкиваясь с
атомом ртути, возбуждая его. Таким образом, возбудить атом ртути, передавая ему
энергию менее 4.9 эВ. невозможно. Оказалось, однако, что возбуждения не
происходит и тогда, когда энергия электрона больше величины 4.9 эВ.
На
дискретность возможных состояний атомов указывает и опыт Штерна и Герлаха, в
котором пучок атомов, обладающих магнитным моментом, направляют в неоднородное
магнитное поле, которое отклоняет атом от прямолинейного пути таким образом,
что угол отклонения зависит от ориентации магнитного момента атома по отношению
к полю. С точки зрения классической физики возможны любые ориентации магнитного
момента атома в поле, поэтому при попадании на экран после прохождения их
сквозь магнитное поле должно получится размытое пятно, соответствующее
изображению щели, ограничивающей поток в начале пути. В действительности
наблюдается два резких изображения щели, т.е. пучок разделяется на две (в общем
случае - несколько) части. Это можно объяснить, что магнитный момент
приобретает только строго определенные значения, таким образом, магнитные
состояния атома дискретны.
Однако
наиболее ярким фактом, противоречащим законам классической физики, оказался
факт самого существования атомов. В опыте Резерфорда впервые была установлена
ядерная модель атома: в центре находится очень маленькое ядро (10-13
см.), несущее положительный заряд +ze, а вокруг находятся z
отрицательно заряженных электронов, заполняющих пространство атома (10-8
см.).
Первое
противоречие такой картины было в следующем: согласно теории электричества
неподвижная система зарядов не может быть устойчивой. Если же предположить, что
электроны вращаются вокруг ядра, то, двигаясь с ускорением, они должны
постоянно испускать электромагнитное излучение, терять энергию и, в конце
концов, упасть на ядро.
Другим
опытом, противоречащим традиционной картине мира был фотоэффект - пороговое
значение энергии ионизации вещества, причем он однозначно свидетельствует о
корпускулярной природе самих электронов.
С
другой стороны было получено неопровержимое свидетельство того, что электрон
является волной! Это были опыты по интерференции электронов.
Непонятными
с классической точки зрения оказались и спектры атомов, которые состоят из
отдельных линий, соответствующих определенным частотам возбуждения. Наиболее
просты спектры водорода и водородоподобных атомов, частоты которых описываются
формулой:
w
= const z2 (1/nk2 - 1/nm2)
Никакой
классической моделью было не возможно объяснить такую форму атомных спектров.
В
1913 году Нильс Бор предложил первую неклассическую модель атома - модель атома
Бора. В этой модели электроны считались корпускулами, обладающими при этом
удивительными свойствами, которые были определены в постулатах модели:
1.
Электроны могут находится
только на строго определенных орбитах - стационарных орбитах, при этом атом не поглощает
и не испускает свет.
2.
Переход электронов может
происходить только с одной стационарной орбиты на другую.
Из
этой модели вытекали сразу множество важных следствий: так были получены
квантовые числа, при помощи которых удалось описать линейчатые спектры атомов,
магнитные моменты атомов, оценить радиусы орбит и скорости вращения электронов
на них. Как дальше мы увидим, квантовые числа, впервые полученные в модели
Бора, имеют четкий физический смысл.
Однако
значение момента одновалентного атома не соответствовало этой картине. Поэтому
Юленбек и Гаудсмит предположили, что в создании магнитного момента атома
существенную роль играет собственный момент электрона, который возникает из-за
того, что электрон, являясь заряженным шариком, вращается вокруг своей оси, в
результате чего у него возникает механический и магнитный моменты.
Безусловно,
модель атома Бора не могла объяснить строение более сложных, не
водородоподобных атомов. Теперь это делается
в рамках квантовой механики, решая уравнение Шредингера для систем ядер и
электронов. Однако, тем не менее, часто химики пользуются с успехом другим
простым модельным подходом, основанным на традиционной картине химической связи
- молекулярной механике.
В
этом подходе считается, что химическая связь представляет собой пружинку,
которую можно или растягивать, или сжимать, а молекулу - как набор атомов.
Сейчас существует много эмпирических способов задания свойств химической связи
- так называемы валентные поля. В общем виде молекулярная механика ищет минимум
энергии, используя потенциальные кривые, типа кривой Морзе, и закон Гука.
Учитываются в таких подходах и потенциалы угловых деформаций, которые, как
правило, выбираются в квадратичной форме. Включаются в этот подход и торсионные
функции, и взаимодействия типа Ван-дер-Ваальса. С использованием всех этих
потенциальных функций находится энергия системы и затем ищется конфигурация с
наименьшей энергией, оптимизируя задачу по 3n-6 координатам. В этом подходе
часто с хорошей точностью получаются структура молекул и фрагментов твердых
тел, теплоты образования, энергии стерического напряжения.
Этот и другие подходы в настоящее время реализованы
в наборе компьютерных программ, с которыми мы будем позже знакомится.