Глава
III.4.
Возможная
схема синтеза-сборки фуллеренов
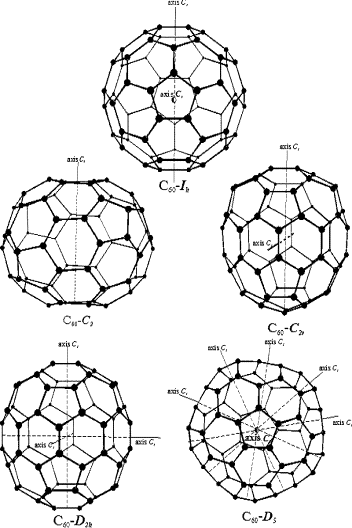
Удивителен сам факт существования фуллеренов с определенной симметрией, хотя причины, по которым среди множества углеродных структур образуются именно они, неизвестны. Например, в макроколичествах обнаружено только по одному изомеру С60 (Рис. 4.1) и С70 с наивысшей симметрией [1,2] и, следовательно, с минимальной энтропией, хотя теоретически возможно существование гораздо большего количества изомеров для каждой молекулы.
|
|
Рисунок 4.1. Некоторые изомеры фуллерена С60. Ih симетрии C60_ih.hin C2 симетрии C60_c2.hin C2V симетрии C60_c2v.hin D2h симетрии C60_d2h.hin D5 симетрии C60_d5d.hin |
Не до конца ясны причины, по которым при одинаковых условиях образуются только некоторые фуллерены с определенной симметрией. Вероятно, сравнение особенностей строения существующих молекул с теоретически построенными фуллеренами, позволило бы понять механизм образования углеродных наноструктур.
Первое предположение, объясняющее формирование фуллеренов, заключалось в том, что с поверхности испаряющегося графита выбрасываются фрагменты монослоев, которые затем сворачиваются в сферическую молекулу [1,3]. Однако в дальнейшем, эксперименты с использованием изотопов углерода, показали, что рост фуллеренов происходит из моноатомного пара. Согласно экспериментальным данным [4,5], конденсация атомов углерода происходит следующим образом: после полного перемешивания атомов в плазме кластеры растут в виде линейных цепочек; при достижении их размера 10 и более атомов, цепочки замыкаются в более стабильные кольцевые структуры.
В настоящий момент известно существование нескольких моделей синтеза молекул фуллеренов [6-11] которые, в основном, построены с использованием методов молекулярно-динамического моделирования. Рассмотрим модели двух типов: капельная модель [7-9] и синтез посредством полициклических структур [10].
В капельной модели был предложен механизм
образования фуллеренов из пересыщенного углеродного пара. В начальной стадии
данного процесса — конденсации, образуются наноразмерные зародыши. При
понижении температуры они группируются в кластеры, увеличение размеров и
усложнение структуры которых приводит к образованию фуллеренов. Таким образом,
согласно капельной модели, образование углеродных молекул происходит в три
стадии. Образование зародыша в виде малых линейных кластеров и их разветвление;
образование циклов и формирования двумерной поверхности; рост поверхности и ее
замыкание в фуллереновые структуры.
Капельная модель объясняет рост «капель»
(фуллеренов) как результат столкновений. При этом перестройка структуры
происходит в течение процесса отжига между столкновениями. Однако данная модель
имеет ряд очевидных недостатков. В частности она не объясняет получение молекул
с высокой симметрией, а также отсутствие структурных изомеров. Например, у С60
кроме симметрии Ih (C60_ih.hin)
(Рис. 4.1) теоретически возможны молекулы с симметрией D2d, C2, C2v,
D5, (C60_d2h.hin,
C60_c2.hin,
C60_c2v.hin,
C60_d5d.hin)
и др. Вместе с экспериментально получаемыми молекулами также ошибочно предсказывается
высокая вероятность существования таких незафиксированных фуллеренов как С58.
В модели полициклических структур [10] при N>20
(N — количество атомов углерода) образуются кластеры, структура которых
интерпретируется как два связанных между собой кольца, в виде пропеллера. При
N>30 появляются кластеры из трех связанных колец в виде бутона цветка и т.д.
Относительное содержание таких полициклических структур растет с размерами и
при N>30 начинает значительно превышать содержание простых колец. Предполагается,
что рост крупных кластеров идет преимущественно путем коагуляции кольцевых
структур. В [10] рассматривается сворачивание в фуллерен структур, состоящих из
трех соединившихся колец в виде бутона, или 3х лопастного
пропеллера. Формирование происходит путем соединения ближайших атомов у
основания структуры и напоминает закрывание бутона. Получающийся фуллерен имеет
эллипсоидную форму и в нем есть смежные пятиугольники, также он может содержать
семиугольные циклы. В дальнейшем происходит расползание пятиугольников по сфере
(как в капельной модели) и, как следствие, уменьшение углового напряжения
структуры (изомеризация Стоуна-Велса [12]).
Модель полициклических структур не объясняет
отсутствие промежуточных фуллеренов, таких как С62, С64,
С66 и т.д., а также изомеров у С60 и С70.
Изомеризация Стоуна-Велса из-за обратимости процесса, вообще говоря,
предполагает наличие нескольких структурных изомеров одного фуллерена, в
частности для С60. Однако на примере высших фуллеренов, можно видеть
(Табл.1), что, имея все предпосылки, в том числе низкую энергетическую разницу,
не все изомеры образуются. Модель также допускает высокую вероятность
существования незафиксированных экспериментально молекул.
Таблица 1
Теплоты образования для изомеров фуллерена С78
рассчитанные методом РМ3
|
Фуллерен |
Теплота образования, К/mol |
Зафиксированные
экспериментально [18] |
|
6100 |
+ |
|
|
6075 |
+ |
|
|
6115 |
+ |
|
|
6110 |
- |
|
|
6185 |
- |
На данный момент в моделях образования фуллеренов не учитывается электронная структура. Моделирование условий синтеза ведется с использованием методов молекулярной динамики на основе модельных потенциалов, которые не отображают сложную электронную структуру при температурах плазмы (3000-50000К).
В данной Главе изучалась электронная структура и энергетические характеристики возможных фуллеренов в основном состоянии, и выявлялись потенциальные отличия между экспериментально зафиксированными и незафиксированными молекулами. При решении этой задачи использовался квантово-химический подход.
Для расчета равновесной атомной и электронной
структур применялся полуэмпирический квантово-химический метод Хартри-Фока РМ3, с использованием программ HyperChem 5.01, и GAMESS [13]. Выбор квантово-химического
метода определен тем, что применение полуэмпирических методов дает увеличение
скорости выполнения расчетов по сравнению с ab-initio.
В то же время, получаемые результаты, как в неэмпирических, так и в
полуэмпирических квантово-химических методах, хорошо согласуются друг с другом.
Полуэмпирические методы адекватно описывают электронную структуру и равновесную
геометрию молекул С60 и С70 (для сравнения в Табл.2 для С60
и С70 также представлены экспериментальные данные из [2]).
Таблица 2
Максимальные и минимальные межатомные
расстояния в молекулах фуллеренов
Фуллерен
|
Длина связи (Å) |
Фуллерен
|
Длина связи (Å) |
||||
|
min |
max |
min |
max |
||||
|
1 |
1,45 |
1,52 |
25 |
1,38 |
1,49 |
||
|
2 |
1,38 |
1,52 |
26 |
1,36 |
1,49 |
||
|
3 |
1,38 |
1,50 |
27 |
1,35 |
1,49 |
||
|
4 |
1,39 |
1,54 |
28 |
1,38 |
1,46 |
||
|
5 |
1,36 |
1,53 |
29 |
1,37 |
1,48 |
||
|
6 |
1,39 |
1,50 |
30 |
1,45 |
1,49 |
||
|
7 |
1,39 |
1,52 |
31 |
1,35 |
1,50 |
||
|
8 |
1,39 |
1,51 |
32 |
1,38 |
1,49 |
||
|
9 |
1,39 |
1,52 |
33 |
1,37 |
1,48 |
||
|
10 |
1,38 |
1,50 |
34 |
1,39 |
1,48 |
||
|
11 |
1,37 |
1,49 |
35 |
1,38 |
1,48 |
||
|
12 |
1,41 |
1,50 |
36 |
1,39 |
1,48 |
||
|
13 |
1,36 |
1,53 |
37 |
1,38 |
1,46 |
||
|
14 |
1,37 |
1,51 |
38 |
1,37 |
1,47 |
||
|
15 |
1,35 |
1,53 |
39 |
1,37 |
1,48 |
||
|
16 |
1,40 |
1,51 |
40 |
1,36 |
1,47 |
||
|
17 |
1,39 |
1,49 |
41 |
1,36 |
1,48 |
||
|
18 |
1,37 |
1,50 |
42 |
1,37 |
1,47 |
||
|
19 |
1,37 |
1,50 |
43 |
1,35 |
1,48 |
||
|
20 |
1,37 |
1,50 |
44 |
1,36 |
1,46 |
||
|
21 |
C48-C2 |
1,38 |
1,50 |
45 |
1,39 |
1,47 |
|
|
22 |
1,40 |
1,49 |
46 |
1,36 |
1,47 |
||
|
23 |
1,38 |
1,48 |
47 |
1,36 |
1,46 |
||
|
24 |
1,37 |
1,49 |
48 |
1,36 |
1,47 |
||
|
|
|
|
|
49 |
1,36 |
1,46 |
|
|
Среднее среди min=1,38Å Среднее среди max=1,49Å |
|||||||
В [14] показано, что полуэмпирические методы MNDO и
РМ3 повторяют результаты неэмпирических расчетов (3-21G) и удовлетворительно
описывают экспериментальные фотоэлектронные данные [15], следовательно, выбор
этих методов для иучения подобных систем представляется вполне оправданным.
С целью выявления зависимостей в атомной и
электронной структуре углеродных кластеров в Главе рассматривалось как можно
большее количество теоретически возможных и существующих углеродных кластеров и
их изомеров. Всего построено 49 фуллеренов, начиная с С20 и до С84
[16-21]. Прежде всего, рассматривались экспериментально зафиксированные
фуллерены С60-Ih, С70-D5d,
C78-C2v, C78-C’2v, C78-D3 [1,2,18] и их изомеры, а также промежуточные
фуллерены, например, С40, С42,…, С62, С64,…
На выбор изомеров влияли затраты на проведение расчетов и разумность выбора их количества
(например, для С36 возможно построить около пятисот различных
изомеров с 3х, 4х, 5и, 6и,
семиугольными циклами [20]). Все рассмотренные в главе фуллерены представлены в
директории Low_isomers.
В Табл.2
представлены длины связей в молекулах фуллеренов. Из-за большого
разброса значений длин связей, для анализа брались только минимальные и
максимальные межъядерные расстояния. Из
табл.2 следует, что для всех представленных молекул, минимальные длины связей
находятся в одном интервале со средним значением длины минимальной связи 1.38Å. Тоже справедливо и для
максимальных длин, среднее для максимальных длин равно 1.49Å. Исходя из того, что межъядерные расстояния для разных
типов связей лежат в определенных промежутках, можно предположить, что атомная
структура у данных фуллеренов подобна.
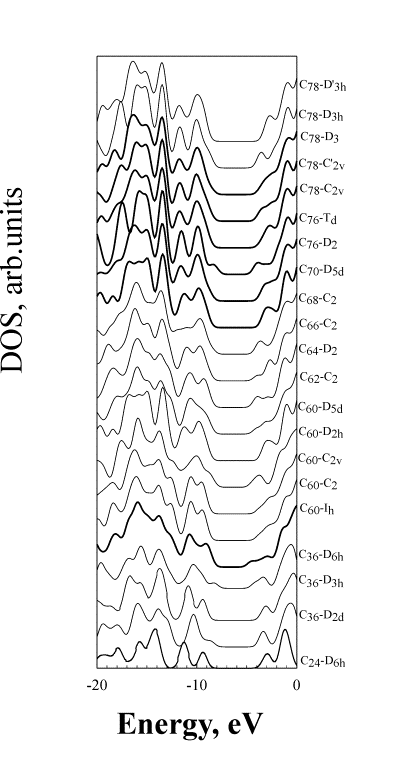
Полные плотности состояний строились как энергетический спектр кластера, в котором энергия каждой молекулярной орбитали представлялась в виде линии, а интенсивности всех линий принимались равными 1. Далее каждая линия заменялась гауссовым распределением с полушириной на полувысоте 0.4eV, и интенсивности всех распределений при каждом значении энергии складывались. Распределение электронных плотностей на Рис. 4.2 показывает отсутствие принципиальных различий в структуре потолка валентной зоны, прежде всего по величине щели и формы пиков, как у известных фуллеренов, так и у не зафиксированных молекул.
|
|
Рисунок 4.2. Полные электронные плотности состояний некоторых молекул фуллеренов (выделенные плотности соответствуют экспериментально зафиксированным структурам). |
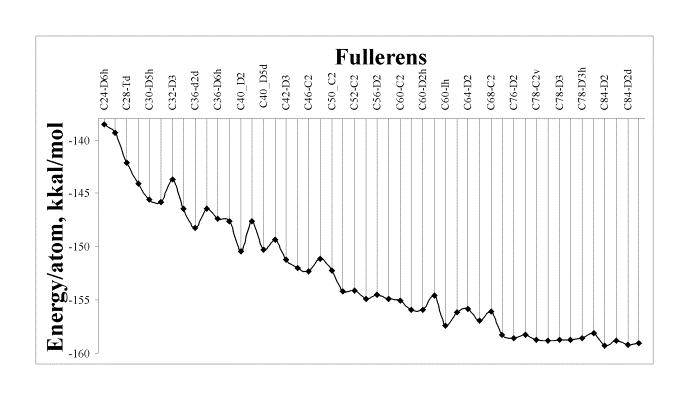
Анализ зависимости полной энергии на атом от молекулярного веса фуллеренов (Рис. 4.3), показывает общую тенденцию к увеличению устойчивости фуллеренов, с ростом их молекулярного веса. Из данной зависимости видно, что фактор отбора по величине полной энергии на атом в процессе образования молекул не играет существенной роли. Так, у зафиксированных С60 и С36, энергии образования отличаются примерно в два раза, но не обнаружено промежуточных фуллеренов (С38, С40, С42, С44, и т.д.) в макроколичествах, несмотря на то, что их энергии образования лежат в интервале между С60 и С36.
|
|
|
Рисунок 4.3. Зависимость полной энергии на атом от молекулярного веса фуллеренов. |
Как видно из правой части графика, разница в полной энергии для высших фуллеренов невелика. По-видимому, это можно объяснить тем, что изомерный эффект в данном случае не играет большой роли как, например, для низших фуллеренов, т.к. пятиугольники в различных изомерах находятся в изолированных состояниях. Таким образом, если судить по энергетическому критерию, должны присутствовать все изомеры высших фуллеренов, потому что энергетическая разница между ними невелика (Табл.1).
С точки зрения электронной и атомной структур, при
сравнении электронных плотностей, длин связей и энергии связей рассчитанных
молекул все рассмотренные фуллерены имеют полное право на существование. Так же
на образование фуллеренов существенно не влияет энтропия, т.к. преимущественно
образуются изомеры с наивысшей симметрией (у С60 — Ih).
Отсюда можно сделать вывод: по атомной и электронной структуре и энергетической
стабильности невозможно дать ответ о возможности образования того или иного
изомера фуллерена.
Таким образом, при построении модели синтеза
фуллеренов, исходя из проведенного анализа атомной и электронной структуры
рассчитанных углеродных кластеров, нужно исключать такие факторы как:
энергетическая выгодность того или иного фуллерена или изомера, особенности
электронного строения, энергия связи получаемого фуллерена. Основываясь на выше
упомянутых факторах, невозможно построить модель, адекватно описывающую
получение только определенных фуллеренов, и процесс отбора существующих молекул
с помощью сравнения их энергий невозможен. Следовательно, необходимо искать
другие условия, влияющие на процесс образования фуллеренов.
Эксперимент показывает (см. выше, [4,5]), что в начале в плазме из моноатомного пара синтезируются структуры С2 — «двойки», и т.п. и кольцевые структуры, с размерами начиная с 10 атомов углерода, причем наличие С10 — «десяток», считается преимущественным [10]. На основе этих экспериментальных данных, молекулы теоретически разбирались на составные части, с последующим выявлением схожих фрагментов между зафиксированными молекулами и различий между экспериментальными и возможными фуллеренами.
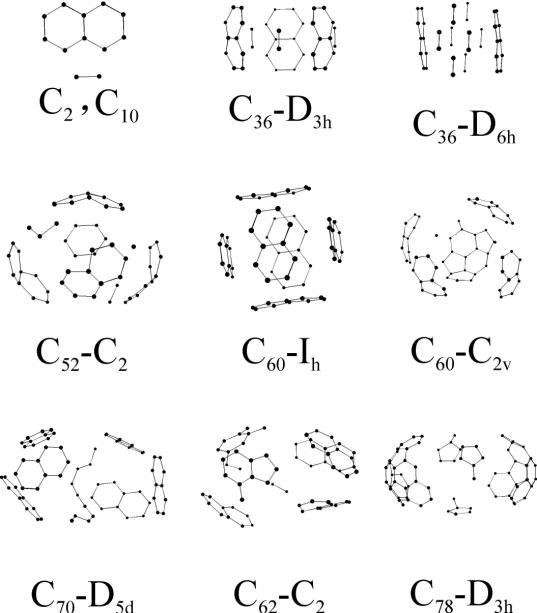
Разобрав визуально экспериментально зафиксированные
молекулы фуллеренов (C60-Ih, C70-D5h,
C78-C2v, C78-C’2v, C78-D3,
и т.д.) на составные части, мы обратили внимание, что у всех существующих
фуллеренов есть схожие фрагменты С2 и С10, или только
фрагмент С10 (в виде сдвоенного шестиугольника), как для С60
(Рис. 4.4). У остальных (незафиксированных) есть дополнительно фрагменты в виде
шестиугольников, одиночных атомов углерода, и т.д. которые не подпадают под
экспериментальные данные. Следовательно, при рассмотрении модели синтеза
фуллеренов мы должны учитывать, что возможно на каком-то этапе, происходит
синтез фуллеренов через структуры С10 и С2, которые
объединяются в «начальный» углеродный кластер — кластер-зародыш.
|
|
|
Рисунок 4.4. Различные визуально
разобранные молекулы фуллеренов на составные части с выделением общего
фрагмента С2 и С10. |
Рассмотрим теперь один из возможных процессов
образования таких молекул как С60 и С70. На первой стадии
происходит синтез углеродных структур в виде линейных цепочек, из моноатомного
потока плазмы [4,5]. На второй стадии линейные структуры замыкаются, при достижении
длины цепи до 10 и больше атомов. Образование двоек и десяток, судя по
экспериментальным данным, является предпочтительным [10]. Далее происходит
последовательное сталкивание и соединение этих структур с образованием
углеродных кластеров-зародышей. На этом этапе для С70 также идет
поглощение микрокластеров С2.
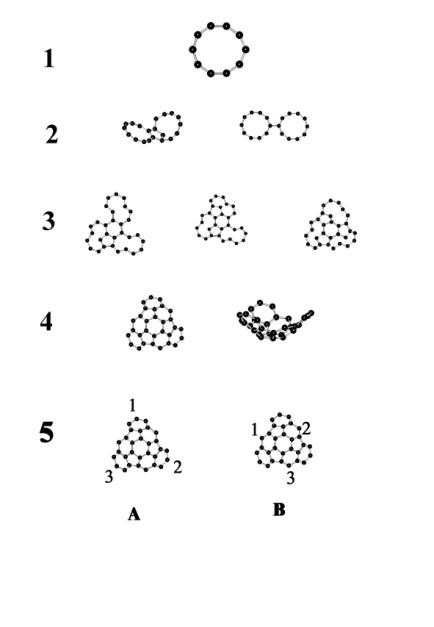
На Рис. 4.5 представлен один из возможных путей, по которому идет процесс образования углеродных кластеров. От симметрии кластера-зародыша будет зависеть конечный продукт синтеза. На данном рисунке представлен возможный путь синтеза для таких молекул как С60 и С70 (для С70 плюс еще пять фрагментов С2). Для молекул фуллеренов с числом атомов >70 возможны кластеры-зародыши с количеством фрагментами больше трех и большей размерностью самих фрагментов.
|
|
Рисунок 4.5. Предположительная схема синтеза-сборки молекул фуллеренов. 1 — образование углеродных цепочек из моноатомного пара, 2, 3 — сталкивание кольцевых структур с образованием одного из возможных углеродного кластера-зародыша — 4 , 5 — три возможных способа столкновения между кластерами-зародышами А и В (1А-1В, 2А-2В, 3А-3В), (1А-2В, 2А-3В, 3А-1В), (1А-3В, 2А-1В, 3А-2В). |
Когда количество кластеров-зародышей возрастает, они начинают сталкиваться, в результате чего происходит сборка больших кластеров с последующей кристаллизацией в молекулы фуллеренов. Здесь, на этом этапе, каждый раз нужно обращать внимание на симметрию получающихся кластеров-зародышей, от этого зависит количество эффективных столкновений приводящих к наращиванию углеродного каркаса. Для случая с С60 кластер-зародыш имеет главную ось симметрии С3 Рис. 4.5.4. В данном случае это, по-видимому, оптимальная симметрия т.к. при столкновении с таким же кластером возможны три способа соединения (каждый раз через угол 2p/3 Рис. 4.5.5). Возможно поэтому, когда симметрия кластера-зародыша низка, (С1) вероятность появления фуллерена на его основе уменьшается, из-за того, что он имеет в своей структуре участки поверхности недоступные для эффективных столкновений приводящих к замкнутой системе — фуллерену.
Подчеркнем, что представленная здесь схема сборки, не единственная, возможно образование начальных кластеров с другой симметрией и соответственно с другой вероятностью сборки в фуллерен.
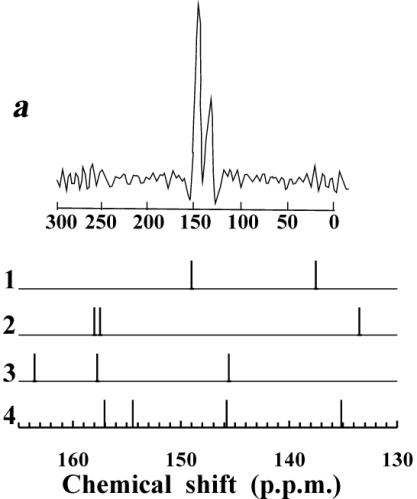
Недавно группой Пискоти был синтезирован в макроколичествах низший фуллерен С36 [21], который был исследован с помощью 13С ЯМР спектроскопии с последующим сопоставлением с теоретическими спектрами ЯМР для различных изомеров С36. Мы на основе построенной модели синтеза-сборки попытались разобрать малый фуллерен С36 и выяснить, какой из возможных изомеров может образовываться и согласовать это с экспериментом ЯМР. По пространственным соображениям, (Рис. 4.4) скорее всего, предпочтительнее и легче образование С36-D3h.
В [21], утверждается, что
спектр ЯМР соответствует симметрии D6h.
Однако полученный при таком разрешении экспериментальный спектр ЯМР можно
интерпретировать и иначе, чем это было сделано у Пискоти. Для этого в нашей
работе был произведен теоретический расчет 13С ЯМР спектров трех
изомеров С36 — D6h,
D2d,
D3h
(первые два соответствуют фуллеренам в [21]) методом GIAO с использованием
базиса 6-31(d). Был проведен сравнительный анализ экспериментального и наших
теоретических ЯМР спектров. Как видно из Рис. 4.6, теоретически рассчитанный
спектр молекулы с симметрией D6h
может соответствовать экспериментальному. Необходимо отметить, что пик в
экспериментальном спектре с химическим сдвигом ~137.5ррм имеет относительно большую полуширину линии, чем пик ~149ррм,
хотя по площади они примерно равны (Рис. 4.6.1). Т.е. возможно в пике с большей
амплитудой (хим. сдвиг 149ррм) две
линии стоят близко друг от друга и поэтому они дают амплитуду в два раза
большую, чем в пике 137.5ррм. Точно
также и в пике 137.5ррм могут
находиться две линии, но которые отстоят друг от друга дальше, чем в пике 149ррм, поэтому пик 137.5ррм дает большую полуширину, но меньшую
амплитуду. Уширение пика со сдвигом 137.5ррм
невозможно объяснить существованием только изомера D6h (Рис. 4.2,
4.3) как в [21]. Возможна ситуация, когда в системе находятся другие изомеры,
например, D3h, (Рис. 4.6.4) чем и можно объяснить уширение
пика 137.5ррм в эксперименте. По
нашему мнению, по пространственным соображениям (Рис. 4.4), предпочтительнее
изомер с симметрией D3h, хотя энергетически он менее выгоден (Рис. 4.3).
|
|
Рисунок 4.6. Спектр 13С
ЯМР малого фуллерена С36. а
- экспериментальный спектр [21] 1 — экспериментальный спектр, 2 — рассчитанный спектр С36—D6h
[21], 3 — наш расчет спектра С36—D6h, 4 — наш расчет спектра С36—D3h. |
Таким образом, с помощью представленной модели синтеза-сборки углеродных структур
можно объяснить существование
структур С36, С60, С70,… И, отсутствие многих малых фуллеренов,
промежуточных структур между С60 и С70, таких как С62,
С64, С66, …, структурных изомеров у молекул С60
и C70, а также многих изомеров у молекул высших фуллеренов т.к. их
невозможно собрать из промежуточных кластеров С10 и С2. В
итоге, при сборке фуллеренов, имеет значение симметрия получаемого
кластера-зародыша и, зависящая от симметрии, вероятность эффективного
столкновения между собой фрагментов кластеров в пространстве плазмы. Именно это
определяет молекулярный вес фуллеренов, а также количество синтезируемых
молекул определенной симметрии.
Таким образом, повторим уже сделанные выводы:
1) Для разработки модели образования углеродных кластеров было теоретически построено 49 фуллеренов. Прежде всего, строились экспериментально зафиксированные молекулы С60-Ih, С70-D5d, C78-C2v, C78-C’2v, C78-D3 и их изомеры. Так как для С36 в настоящее время еще неизвестна симметрия, были построены три изомера D6h, D2d, D3h. Также рассматривались промежуточные фуллерены, например, С40, С42,…, С62, С64,…
2) С точки зрения атомной и электронной структуры, нет запрета на существование любых фуллеренов, в структуру которых входят пяти- и шестичленные циклы.
3) Для проверки модели синтеза-сборки исследован недавно открытый низший фуллерен С36. На основе нашей модели и сравнения расчетных и экспериментальных спектров ЯМР предсказывается, что наиболее вероятным представляется образование фуллерена С36-D3h.
4) В работе представлена возможная схема образования молекул фуллеренов на основе «двоек» и «десяток», разработанная на схожести экспериментально зафиксированных молекул (их составных частей) и, соответственно, на различии экспериментально получаемых фуллеренов с гипотетическими углеродными кластерами. В данной модели влияние электронного строения и энергетических характеристик, как факторов, в процессе высокотемпературного синтеза, можно считать незначительным. Изомеризацию Стоуна-Велса также, по-видимому, надо исключать из рассмотрения.
Невозможность проведения адекватного квантово-химического моделирования в условиях высокотемпературного синтеза фуллеренов приводит к построению формальных феноменологических моделей, которые основываются на экспериментальных данных поведения атомов углерода в плазме и косвенных свидетельствах, базирующихся на морфологическом сходстве между зафиксированными углеродными кластерами.
У кластера-зародыша высокой симметрии больше вероятность эффективных столкновений, которые приводят к фуллерену с высокой симметрией. Таким образом, от вида кластера-зародыша зависит симметрия будущего фуллерена, молекулярный вес, и количество синтезируемых молекул.
СПИСОК ЛИТЕРАТУРЫ К ГЛАВЕ III.4.
1. Kroto H.W., Heath J.K., O’Brien S.C., Curl R.F., Smalley R.E. Nature,
318, 162 (1985).
2. А.В. Елецкий, Б.М.
Смирнов. УФН, 165,
977 (1995).
3.
Robertson D.H., Brenner D.W., White C.T. J.Phys.Chem., 96, 6133 (1992).
4. Meijer G., Bethune D.S. J.Chem.Phys., 93, 7800 (1990).
5. Hawkins J.M., Meyer A., Loren S., Nunlist R.
J.Amer.Chem.Soc., 113, 9394 (1991).
6. Ю.Е. Лозовик, А.М.
Попов. УФН, 167, 751, (1997).
7.
Maruyama S. & Yamaguchi Y. Proc.32nd National Heat Transfer
Conf., p.839 (1995).
8.
Maruyama S. & Yamaguchi Y. Therm.Sci.&Engng., 3, 105 (1995).
9. Т.Ю. Астахов, Г.А.
Виноградов, Ш.А. Шагинян. ЖФХ, 2,
310 (1997).
10. А.Л. Александров, В.М. Беданов, Ю.Н. Мороков, В.А. Швейгерт. ЖСХ, 37, 664 (1996).
11. В.И. Березкин. ФТТ, 42, 567 (2000).
12. Stone A.J., Wales D.J. Chem.Phys.Lett, 128, 501 (1987).
13. M.W. Shmidt, K.K. Baldridge, J.A. Boatz,
S.T. Elbert, M.S. Gordon, J.H. Jensen, S. Koseki, N. Matsunaga, K.A. Nguyen, S.J.
Su, T.L. Windus, M. Dupuis, J.A. Montgomery. J.Comp.Chem., 14, 1347 (1993).
14. С.А. Варганов, П.В. Аврамов, С.Г. Овчинников. ФТТ, 42, 378 (2000).
15. А.Л. Шахмин, С.В. Мурашов, Н.В. Баранов, М.А. Ходоровский. ФТТ, 40, 168 (1998).
16. G.B. Adams, M. O’Keeffe,
R.S. Ruoff. J.Phys.Chem., 98, 9465 (1999).
17. B.L. Zhang, C.Z. Wang, K.M. Ho. Phys.Rev., B47, 1643 (1993).
18. X.-Q. Wang, C.Z. Wang, B.L. Zhang, K.M. Ho.
Chem.Phys.Lett., 200, 35 (1992).
19. B.L. Zhang, C.Z. Wang, K.M. Ho, C.H. Xu,
C.T. Chen. J.Chem.Phys., 97, 5007
(1992).
20. Z. Slanina, X. Zhao, E. Osawa. Chem.Phys., 219, 193 (1997).
21.
Piskoti C., Yargen J., Zettl A. Nature, 393,
771 (1998).